 |
Российская Ассоциация
(РАМЛД) |
г.Москва, 119526, а/я 117, РАМЛД,
т/ф.: (495) 433-24-04
|
автор: Ким Ю.В., Потехин О.Е., Токар М.И., Шибанов А.Н. ЗАО “А/О Юнимед”. год издания: 2003 |
ЧТО МЫ ИЗМЕРЯЕМ В МОЧЕ СУЛЬФОCАЛИЦИЛОВЫМ МЕТОДОМ?
В нашей стране для определения концентрации белка в моче преимущественно применяют турбидиметрический метод с использованием сульфосалициловой кислоты (сульфосалициловый метод), который впервые был предложен Kingsbury F.B. и соавторами в 1926 г. В то же время, лаборатории развитых стран этот метод практически не используют, в результате лабораторный контроль качества анализа мочи на белок демонстрирует снижение коэффициента вариации. Так в 1993 году 60% клинико-диагностических лабораторий Франции выполняли определение концентрации белка мочи колориметрическим методом с использованием красителя пирогаллоловый красный (пирогаллоловый метод) и лишь 10% - сульфосалициловым методом. Диагностические наборы для определения белка в моче, основанные на пирогаллоловом методе, выпускают такие известные фирмы как Bayer Diagnostics, Beckman, Biodirect, Biocon Diagnostik, Bio-Rad Laboratories, Eurodiag, Kone, Merck, Randox, Serono, Sentinel CH, Sigma. К сожалению, в нашей стране в силу экономических причин и отчасти из-за отсутствия опыта колориметрические методы определения белка мочи пока используются крайне мало.
Возникает вопрос – насколько оправдан отказ лабораторий развитых стран от применения простого и, главное, – дешевого метода. Для выяснения этого вопроса мы провели сопоставление результатов определения концентрации белка в моче пациентов двумя методами: сульфосалициловым [1] и пирогаллоловым [2].
Порядок выполнения измерения концентрации белка каждым из методов был следующий.
Сульфосалициловый метод.
Реагенты: 3% раствор сульфосалициловой кислоты, 0,9% раствор хлорида натрия,
калибратор (калибровочный раствор сывороточного альбумина, 50 г/л, в растворе хлористого натрия, 0,9% и азида натрия, 0,095%) из набора «Юни-Тест – Общий белок» производства ЗАО “Диакон ДС” по заказу ЗАО “А/О Юнимед”.
Оборудование: спектрофотометр СФ-2000 производства ОКБ “Спектр”.
Ход измерения: в кварцевую кювету с длиной оптического пути 1 см вносили 0,5 мл профильтрованной мочи и 1,5 мл 3% раствора сульфосалициловой кислоты, перемешивали. Через 10 мин измеряли оптическую плотность на спектрофотометре при длине волны 595 нм против холостой пробы (кювета с 0,5 мл мочи и 1,5 мл 0,9% раствора хлорида натрия). Расчет концентрации белка проводили по калибровочному графику. Для его построения готовили разведения стандартного раствора сывороточного альбумина человека в 0,9%-м растворе хлорида натрия с концентрациями: 0,025; 0,05; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9 г/л. Для каждого из приготовленных растворов выполняли измерение так же, как с для пробы мочи. Калибровочный график показан на рис.1.
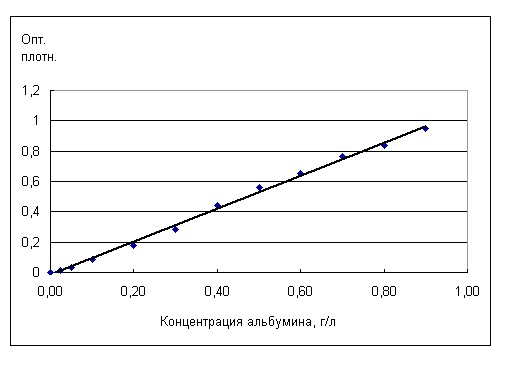
Рис. 1. Калибровочная кривая для определения белка в моче сульфосалициловым методом.
Пирогаллоловый метод.
Использован коммерческий набор производства компании Biocon Diagnostik (Германия) – Fluitest USP – Белок, сверхчувствительный метод на основе красного пирогаллол-молибдатного комплекса.
Реагенты: пирогаллоловый красный, 0,06 ммоль/л, молибдат натрия, 0,04 ммоль/л, сукцинатный буфер 50 ммоль/л, рН 2,5, детергенты 2%; калибратор (калибровочный раствор сывороточного альбумина, 50 г/л, в растворе хлористого натрия, 0,9% и азида натрия, 0,095%) из набора «Юни-Тест – Общий белок» производства ЗАО “Диакон ДС” по заказу ЗАО “А/О Юнимед”. [3].
Оборудование: биохимический фотометр StatFax 1904 Plus (“Awareness Technology inc.”, США).
Калибровочную кривую для описываемого метода при соотношении проба/реагент – 1/12,5 получали с помощью специально приготовленных растворов сывороточного альбумина: 0,05; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9; 1,0, г/л путем разведения калибратора (50 г/л) с помощью 0,9% раствора хлорида натрия, (Рис.2).
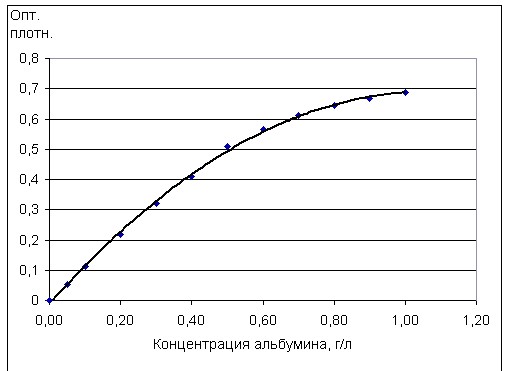
Рис, 2. Калибровочная кривая для метода пирогаллоловый красный, реагент Fluitest USP, Biocon Diagnostik (Германия) при соотношении проба/реагент – 1/12,5.
Из каждого раствора белка брали по 80 мкл и смешивали с 1,0 мл реагента; выполняли измерение как пробы мочи.
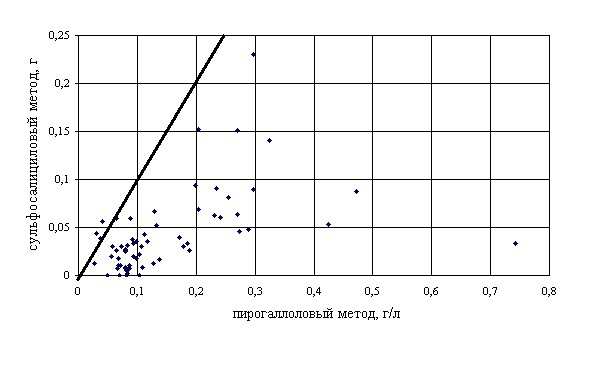
Рис. 3. Диаграмма сопоставимости результатов измерения содержания белка в образцах мочи сульфосалициловым и пирогаллоловым методами.
Калибровочную кривую для реагента производства А/О Юнимед и фирмы Biocon Diagnostik при соотношении проба/реагент – 1/30 получали с помощью специально приготовленных растворов сывороточного альбумина: 0,05; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9; 1,0, 1,1; 1,2;1,3;1,4;1,5;1,6; 1,7; 1,75; 1,8; 1,85; 1,9; 2,0 г/л путем разведения калибратора (50 г/л) с помощью 0,9% раствора хлорида натрия (Рис.4).
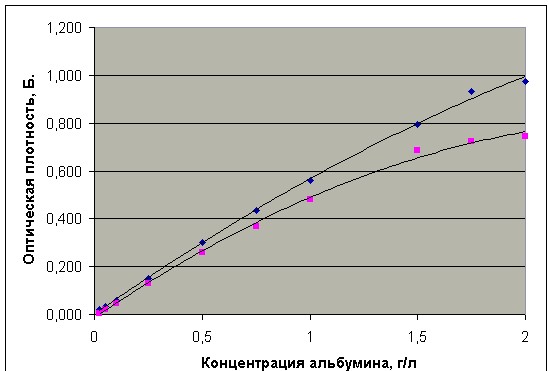
Рис. 4. Калибровочные кривые для реагента производства А/О Юнимед (верхний график) и набора Fluitest USP фирмы Biocon Diagnostik (нижний график) при соотношении проба/реагент – 1/30.
Из каждого раствора белка брали по 50 мкл и смешивали с 1,5 мл реагента и выполняли измерение как пробы мочи.
В проведенном исследовании для достижения максимальной чувствительности пирогаллолового метода был использован его модифицированный высокочувствительный вариант. Для этого объем добавляемой мочи был увеличен. Ход измерения: во все пробирки вносили 1 мл основного реагента, затем в первую пробирку вносили 80 мкл дистиллированной воды (бланк), в остальные пробирки по 80 мкл отцентрифугированной мочи, инкубировали при комнатной температуре в течение 10 минут и измеряли оптическую плотность пробы против бланка при длине волны 600 нм и дифференциальном светофильтре 650 нм
Для сопоставления методов определения концентрации белка в моче были проведены измерения 60 проб мочи пациентов сульфосалициловым и пирогаллоловым методами.
Чувствительность методов измерения белка в моче оценивали путем исследования приготовленных водных растворов мочи, содержащих низкие концентрации сывороточного альбумина (от 0 до 0,05 г/л). Для пирогаллолового и сульфосалицилового методов нами также были исследованы величины неспецифического поглощения за счет окраски образца мочи. Для этого измерялась оптическая плотность проб мочи, в которые вместо сульфосалициловой кислоты или пирогаллолового реактива добавлялось эквивалентное количество физиологического раствора.
Для оценки влияния матрицы (мочи) на результаты сульфосалицилового метода были проведены следующие опыты.
1) В образцы мочи, не содержащие белка по данным пирогаллолового и сульфосалицилового методов (n=43), был добавлен человеческий сывороточный альбумин в конечной концентрации 0,4 г/л. Затем с помощью вышеуказанных методов была определена концентрация белка в подготовленных образцах.
2) Образцы мочи (n=16), имеющие белок по данным пирогаллолового метода, были разведены в два раза 0,9% раствором хлорида натрия. Полученные пробы были вновь исследованы сульфосалициловым методом, концентрация белка была пересчитана с учетом разведения.
Результаты исследования и их обсуждение
Исследование образцов мочи, содержащих определенные концентрации альбумина показало, что минимально определяемая концентрация альбумина (чувствительность метода) составила для сульфосалицилового метода 0,033 г/л, а для пирогаллолового метода – 0,012 г/л.
Результаты измерений в виде диаграммы сопоставимости результатов измерения содержания белка в образцах мочи сульфосалициловым (ось ординат) и пирогаллоловым (ось абсцисс) методами приведены на рис 3. Сплошная наклонная линия на графике соответствует равенству результатов измерений двумя методами. Если бы оба метода давали близкие значения, то точки на графике должны были бы группироваться возле сплошной линии. Данные, приведенные на рис. 3, позволяют также отметить, что сульфосалициловый метод стабильно показывал более низкие концентрации белка во всех пробах мочи по сравнению с пирогаллоловым методом.
Как показало проведенное исследование, между результатами, получаемыми с помощью сульфосалицилового и пирогаллолового методов, отсутствует убедительная статистическая связь. Кроме того, по сравнению с пирогаллоловым методом, сульфосалициловый метод в 95% образцов мочи показал более низкие значения концентрации белка. При этом в 86% случаев измерение сульфосалициловым методом дало заниженные результаты в два и более раз по сравнению с пирогаллоловым методом.
В тоже время сульфосалициловый метод в ряде случаев показал присутствие белка в пробе за счет темного цвета или повышенной мутности исследуемой мочи. Установлено, что при определении белка сульфосалициловым методом (соотношение проба/реактив = 1/3) при длине волны 595 нм, вклад образца мочи за счет его цвета или степени мутности в получаемый результат может составлять от 0 до 0,247 г/л (среднее значение – 0,031 г/л). Таким образом, следует признать, что при использовании сульфосалицилового метода применение контрольной пробы (образец мочи+физраствор) для каждого образца мочи обязательно. При определении белка пирогаллоловым методом цвет или степень мутности образца мочи не оказывали влияния на получаемый результат.
Опыт по оценке влияния матрицы (мочи) показал, что практически во всех приготовленных пробах мочи, содержащих 0,4 г/л альбумина, его концентрация, определенная сульфосалициловым методом, была ниже 0,4 г/л в среднем на 20% (пограничные значения концентрации белка 0,29-0,34 г/л). В тоже время при измерении концентрации белка в этих пробах пирогаллоловым методом, результаты для всех образцов были в пределах 0,40-0,46 г/л. Также при оценке влияния матрицы (мочи) на результаты измерения концентрации белка сульфосалициловым методом было установлено, что в 5 из 16 двукратно разведенных образцах мочи концентрация белка была на 15-33% выше, чем в соответствующих не разведенных образцах. Для окончательного выяснения влияния матрицы на результаты сульфосалицилового метода требуется проведение исследований на большом количестве образцов мочи.
Таким образом, полученные данные свидетельствуют о преимуществах пирогаллолового метода перед сульфосалициловым методом вследствие его более высокой чувствительности и неподверженности влиянию интерферирующих факторов, отсутствии необходимости в холостой пробе по моче, возможности использования одного стандарта для построения калибровочной кривой, малого количества мочи для анализа. Наличие таких характеристик позволяет рекомендовать пирогаллоловый метод для широкого применения в лабораторной практике.
Из полученных данных вытекает вывод – результаты измерения концентрации белка в моче сульфосалициловым методом несопоставимы с результатами, полученными пирогаллоловым методом. Этот факт и является ответом на вопрос – почему лаборатории развитых стран не используют сульфосалициловый метод. Применение этого метода в слаборазвитых странах, по-видимому, объясняется тем, что там ценовой фактор превалирует над точностью и диагностической значимостью получаемых результатов, а, учитывая представленные на рис. 3 результаты, можно сказать, и над здравым смыслом. Кому нужен такой анализ, когда при концентрации белка в моче 0,3 г/л результат измерения может быть от 0,05 до 0,25 г/л? Что же касается ценового фактора, то, как известно, скупой платит дважды. Ошибочные результаты анализа приводят к ошибочному диагнозу и неэффективному лечению больного. Основная опасность применения сульфосалицилового метода состоит в том, что мы получаем значительно заниженные значения и не редко пропускаем протеинурию. Следовательно, данный метод нельзя применять даже для скрининга.
Так что же мы измеряем сульфосалициловым методом? Метод относится к классу турбидиметрических, в основе которых лежит измерение изменения светопропускания (DD) реакционной смеси, обусловленное рассеянием света (образованием мутности). В случае определения белка в моче мутность образуется за счет следующего процесса: молекулы белков мочи в кислой среде денатурируют, переходя из компактной глобулярной формы в рыхлую «нитчатую» форму. При этом у белков резко возрастает способность образования конгломератов (реакция преципитации). Отдельные молекулы белка имеют размеры меньше длины волны видимого света и поэтому очень слабо рассеивают его. Эффективность рассеивания резко возрастает, когда размеры образующихся конгломератов молекул белка, приближаются к величине 0,6 мкм (длине волны зондирующего света). Чем больше концентрация белка в моче, тем большее количество таких конгломератов (центров рассеивания) образуется. Однако, связь между измеряемой на фотометре оптической плотностью DD и концентрацией белка в моче очень сложная. На начальном этапе реакции образуется определенное количество мелких белковых частиц, затем они начинают слипаться в более крупные частицы, при этом концентрация центров рассеивания падает, а эффективность (сечение) рассеивания каждого центра растет. В каждый конкретный момент времени мы имеем в реакционной смеси определенное количество центров рассеивания с различными размерами. При больших концентрациях белка в моче могут образовываться крупные белковые частицы, выпадающие в осадок, что приводит к уменьшению оптической плотности реакционной смеси.
Процесс денатурации белков и реакция преципитации зависят от состава среды, в которой они протекают (рН, концентрация различных солей). Для калибровки метода мы используем водный раствор альбумина человека с добавлением 0,9% хлористого натрия. Когда же мы выполняем измерение концентрации белка в моче, мы не знаем и не учитываем ни рН мочи, ни ее солевой состав. Так же мы не учитываем тот факт, что различные белки по-разному реагируют в растворе сульфосалициловой кислоты. Этим и объясняется большой разброс результатов измерений, представленных на рис. 3. Чем ближе состав мочи к составу калибратора, тем точнее результат измерения. Однако таких проб мочи встречается очень мало. В большинстве случаев состав мочи таков, что результаты измерений получаются заниженными и нередко весьма значительно.
Последнее подтверждается описанным выше экспериментом, в котором выполнили измерение концентрации белка сульфосалициловым методом в неразведенных и двукратно разведенных пробах мочи. Сравнение полученных данных показало, что разведение мочи (с учетом степени разведения) приводит к росту результатов измерений концентрации белка на 15-33%. Этот факт подтверждает существенное влияние состава мочи на результат определения концентрации белка (эффект матрицы).
Почему пирогаллоловый метод позволяет получать более точные результаты измерения концентрации белка в моче? Во-первых, за счет большей кратности разведения пробы мочи в реакционной смеси. Если в сульфосалициловом методе отношение проба мочи/реагент составляет 1/3, то в пирогаллоловом методе оно может быть в пределах от 1/12,5 до 1/60 в зависимости от варианта методики, что значительно уменьшает влияние состава мочи на результат измерения. Во-вторых, реакция протекает в сукцинатном буфере, то есть при стабильном рН. И, наконец, сам принцип метода, если можно так сказать, более прозрачный. Молибдат натрия и краситель пирогаллоловый красный образуют комплекс с молекулой белка. Это приводит к тому, что молекулы красителя, в свободном состоянии не поглощающие свет на длине волны 600 нм, в комплексе с белком свет поглощают. Таким образом, мы как бы метим каждую молекулу белка красителем и в результате получаем, что изменение оптической плотности реакционной смеси на длине волны 600 нм однозначно связано с концентрацией белка в моче.
В качестве заключения наиболее существенные различия между сульфосалициловым методом определения белка в моче и методом с использованием красителя пирогаллоловый красный представлены в таблице № 1.
Таб. № 1. Сравнительная характеристика двух методов определения белка в моче (сульфосалициловый и пирогаллоловый метод)
|
Основные характеристики |
Сульфосалициловый метод |
Пирогаллоловый метод |
Чувствительность |
0,033 г/л |
0,012 г/л |
|
Линейность |
до 0,8 г/л |
до 1,5 г/л |
|
Объем пробы |
1 мл |
0,02-0,08 мл |
|
Объем реактива |
3 мл |
1 мл |
|
Количество калибраторов |
5-6 |
1 |
|
Холостая проба по реагенту |
+ |
+ |
|
Холостая проба по образцу |
+ |
- |
|
Необходимость фильтрации мутных образцов |
+ |
- |
|
Фотометрирование |
только в кварцевых кюветах |
в кварцевых кюветах и пробирках |
|
Стабильность окраски продукта реакции |
- быстрое выпадение преципитатов в осадок |
+ |
|
Возможное влияние рН пробы на результат |
+ |
- |
|
Приготовление реактива |
Взвешивание реактива и его разведение |
Реактив готов к употреблению |
|
Лаборатории, в которых применяется метод |
Лаборатории России и стран Африки |
Лаборатории экономически развитых стран |
Как видно на рис. 2, в использованной нами высокочувствительной методике (реактив фирмы Biocon Diagnostik) при соотношении проба/реагент – 1/12,5 калибровочный график нелинеен начиная с концентраций 0,5 г/л. Хотя многие современные фотометры позволяют выполнять автоматическую нелинейную калибровку, однако это, все же, неудобно. Для увеличения линейности и чувствительности пирогаллоллового метода нами была проведена работа по усовершенствованию рецептуры реагента. Калибровочный график для реагента производства А/О Юнимед и пирогаллового реактива фирмы Biocon Diagnostik при оптимальном соотношении проба/реагент – 1/30 показан на рис. 4.
Сколько-нибудь заметные отклонения от линейности при соотношении проба/реагент – 1/30 для реактива фирмы Biocon Diagnostik наблюдаются начиная с концентрации белка в пробе 1,5 г/л, а для реагента А/О Юнимед - с концентрации белка в пробе 1,75 г/л.
Учитывая исключительную важность обсуждаемой в настоящей статье проблемы, А/О Юнимед и НПП Техномедика выполнили разработку специализированного фотометра для определения концентрации белка в моче с применением реагента пирогаллолового красного. В настоящее время прибор находится на испытаниях в Минздраве России и мы рассчитываем до конца года приступить к серийному выпуску. В приборе реализованы те же принципы, что и в хорошо известном гемоглобинометре МиниГем 540. Появление этого прибора в сочетании с недорогим реагентом позволит всем лабораториям России исключить из своей практики применение давно устаревшего метода определения белка в моче.
1. 1. Kingsbury F.B., Clark C.P., Williams G., Post A.L.. // J. Lab. Clin. Med. – 1926 – Vol.11 – P. 981-989.
2. 2. Watanabe N., Kamei S. // Clin. Chem. – 1986 - Vol. 32 - P.1551-1554.
3. 3. Инструкция по применению набора Fluitest USP компании Biocon Diagnostik (Германия).
|
автор: Ким Ю.В., Потехин О.Е., Токар М.И., Шибанов А.Н. ЗАО “А/О Юнимед”. год издания: 2003 |
|



